молекулна маса
Масите на атоми и молекули се различават значително. Какви ценности ги характеризират комфортно? Как да се определи броя на атомите в никакъв видим с просто око тяло?
Тегло на водните молекули. Теглата на отделните молекули и атоми са много малки. Например, 1 г вода, съдържаща 3,7 • 22 октомври молекули. Следователно, масата на една молекула вода (Н2 0) е равен на:
Масата на същия ред са молекули на други вещества, с изключение на големи молекули на органични вещества; например, протеини имат тегло на стотици хиляди пъти по-голяма от масата на отделните атоми. Но все пак теглото им в микроскопичен мащаб (в грамове и килограми) е изключително малка.
Относителна молекулна маса. Тъй като молекулното тегло е много малък, което не се използва при изчисляването на абсолютните стойности на масата, но относително. Чрез международен договор тегло на всички атоми и молекули, в сравнение с 1/12 масата на въглероден атом (т.нар въглероден маса атомен мащаб). Относителна молекулна (или атомно) тегловно съотношение на масата наричаме veschestvaMr молекула (или атом) m0 на веществото до 1/12 от масата на въглероден атом m0C:
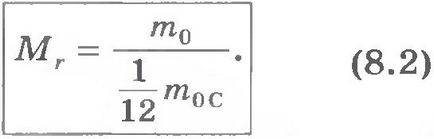
Относителните атомните маси на всички химически елементи точно измерени.
Добавянето на относителните атомни тегла на елементите, които съставляват вещество на молекулата, може да се изчисли относителна молекулна маса на веществото. Например, относителна молекулна маса на CO2 въглероден диоксид е приблизително равна на 44, тъй като относителната атомната маса на въглерод е точно равен на 12 и кислород от около 16: 12 + 2 = 44 16 •.
Количеството вещество и Число на Авогадро Количеството вещество най-естествен за измерване на броя на атоми или молекули в тялото. Но броят на молекулите в никакъв видим с просто око тяло е толкова голяма, че изчисленията, не са абсолютният брой на молекули, както и относителния брой.
Международната система единици количество вещество, изразено в молове. Един мол - количество на веществото, който съдържа същия брой молекули или атоми, както въглеродни атоми, съдържащи се в масата на 0,012 кг.
Това означава, че в един мол от всяко вещество съдържа същия брой атоми или молекули. Това е броят на атомите, определени номер и име на Авогадро NA след италианския учен (XIX инча).
За да се определи необходимостта от постоянна Авогадро да намерите маса от един въглероден атом. Една приблизителна оценка на масата може да се направи както бе направено по-горе за масата на молекула вода (най-точни методи се основават на отклонението на йон греди електромагнитно поле).
За измерване на тегло въглеродни атоми получаване :.
NA Авогадро константа може да бъде определено чрез разделяне на тегло на въглерода, взети в количество от един мол, по отношение на теглото на въглеродния атом:
Определяне мол -1 показва, че NA - брой атоми в 1 мол на всяко вещество. Ако, например, количеството вещество. броят на молекули в тялото. Това показва, че количеството на веществото е съотношението на броя N на молекули в тялото на Авогадро постоянна НС. .. Т.е. на броя на молекули в 1 мол на веществото:
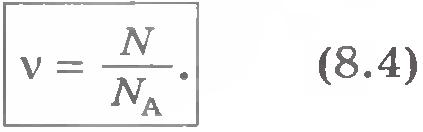
Огромни числова стойност на Авогадро постоянно показва колко малък микроскопичен мащаб в сравнение с видим с просто око. Тяло с количеството вещество на 1 мол, е познат ни макроскопични размери и тегло от порядъка на няколко десетки грама.
Моларното маса. Заедно с относително молекулно тегло н по физика и химия се използват широко понятие на моларна маса. Моларен маса М вещество наречен тегло вещества, взети в количество от 1 мол.
Според тази дефиниция, моларната маса на веществото е масата на молекула продукт на константата на Авогадро:
Маса m всяко количество вещество е продукт на масата на молекула на броя молекули в тялото:
Смяна НА и N във формула (8.4) от техните изразяване на формули (8.5) и (8.6), получаваме
Количеството вещество, равна на масата на вещество своята молекулна маса. Това е определението за количеството вещество е дадено в учебник химия.
Броят на молекули на всяко количество вещество съм маса и молекулна маса М според уравнения (8.4) и (8.7) е:
Формули (8.2), (8.4) и (8.5) дават определянето на нови физически величини, като относителна молекулна маса, броя на вещества и молната маса. Вие не можете да ги получите, те трябва да бъдат лесни за запомняне. Останалата част от формулата например (8.7) и (8.8) могат да бъдат получени.
.
1. Какво е относителна молекулна маса на вода?
2. Колко молекули в двата мола вода?
3. Може ли да се докаже, че моларната маса М е свързано с относително съотношение M≈10 молекулно тегло -3 н мол • кг -1
(В доказване необходимо да се използва с формула (8.5), (8.2), както и масата на въглеродни атоми и константата на Авогадро.)
G.Ya.Myakishev, B.B.Buhovtsev, N.N.Sotsky физика 10 клас
Ако имате корекции или предложения на този урок, моля свържете се с нас.
Ако искате да видите и другите корекции и предложения за уроци, погледнете тук - Образователен форум.