Степента на окисление - което е как да се определи стойността на степента на окисление на елементи
Такава учебен предмет като химия, предизвиква многобройни трудности в по-голямата част от днешните студенти, много малко хора биха могли да определят степента на окисление в съединенията. Най-голямата трудност при ученици, които изучават неорганична химия, това е, учениците в основното училище (8-9 степени). неразбиране на обекта води до харесва учениците към темата.

Какви теми химия разбира се дава на студентите най-трудно?
В рамките на новата програма в рамките на дисциплината "Химия" основен училище включва няколко основни теми: периодичната таблица на елементите, Г. И. Mendeleeva, неорганични класове вещества, йонен обмен. Трудната дадени клас определят степента на окисление на оксиди.
правила за разположения
Първо на всички студенти трябва да бъде наясно, че два елемента оксиди са сложни съединения, в които съставът включва кислород. Предпоставка двоичен съединение, принадлежащо към класа на оксиди е кислород второ място в дадено съединение.
Изчислете като индекс в даден клас от формули се получава само ако студентът има специфичен алгоритъм.
Алгоритъм за кисели окиси
За да започнете, ние отбелязваме, че степента на окисление е цифрово изражение на валентността на елементите. Киселинни оксиди са образувани с метали или неметали валентност 4-7, а вторият се изисква в тези окиси е кислород.
кислород валентните оксиди винаги съответства на две, може да се определи съгласно елементи от периодичната таблица D. I. Mendeleeva. Това е типичен неметални като кислород, а в група 6 от периодичната таблица на главния подгрупата, приема два електрона, за да се завърши напълно външната енергийно ниво. Неметали в кислородни съединения често проявяват най-висока валентност, която отговаря на броя на самата група. Важно е да се напомни, че степента на окисление на химичните елементи е индикатор предположи с положителен (отрицателен) номер.
Неметални престояване в началото на формула има положителен окисление. Неметални оксиди в, неговата -2 пречупване на кислород-стабилен. С цел да се провери точността на хармонизирането на ценностите в киселинни оксиди трябва да умножи всички числа, които съхранявате на индексите на конкретния елемент. Изчисленията се считат за валидни, ако се получава от сумата на всички плюсове и минуси на поставените 0 градуса.

Получаване на два елемента формули
Степента на окисление на атомни елементи има възможност за създаване и записване на съединение с два елемента. При създаване на формула за започване на двете символи близо предписано, внимателно втория даде кислород. На върха на всеки от записаните марки предписана стойност на степента на окисление, а след това са намерени между цифрите е числото, което ще бъде без никакво дели от двете числа. Индикаторът трябва да бъдат разделени индивидуално от цифровата стойност на степента на окисление до получаване на индекси за първия и втория компонент на материала на два елемента. Високо състояние на окисляване е числено равно на стойност по-висока валентност типичен неметални е идентичен с броя на група, където PS е неметални.
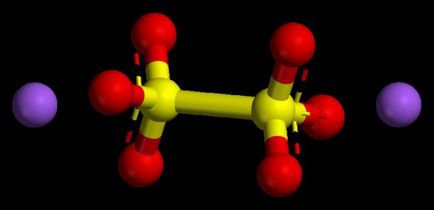
Изпълненията на алгоритъм числени стойности в основни оксиди
Такива съединения се считат за характерни метални оксиди. Те са във всички съединения имат размер на степента на окисление на не повече от една или две. За да се разбере каква ще бъде степента на окисление на метала, е възможно да се възползва от периодичната система. В метали основните подгрупи от първата група, този вариант е винаги постоянна, тя е подобна на номера на групата, който е един.
Метали основната подгрупа от втората група също се характеризират със стабилна окисление 2 числено. Степента на окисление на размера на оксиди, с оглед на техните индекси (числа) трябва да даде нула, тъй като химичният се счита неутрална молекула, лишена от частиците заплащане.
Привеждането на окисляване на кислород-съдържащи киселини
Киселините са сложни вещество, съставен от един или повече водородни атоми, които са свързани с някои киселинен остатък. Като се има предвид, че степента на окисление е числова цели за тяхното изчисляване изисква някои умения по математика. Такъв индикатор на водород (протонен) винаги стабилен в киселини, е едно. Освен това е възможно да се посочи степента на окисление на отрицателен кислороден йон, също така е стабилна, -2.
Едва след тези стъпки, то е възможно да се изчисли степента на окисление на централния компонент на формулата. Като специфичен проба помисли елементи, определящи степента на окисление в сярна киселина, H2SO4. Като се има предвид, че в молекулата на комплекс веществото съдържа две водород протон, 4 кислородни атоми, ние получаваме израз на формата + 2 + X-8 = 0. За да обобщим, образуван нула, г е степента на окисление на сярата 6
Привеждането на окисление в солите
Солите са сложни съединения, съставени от метални йони и един или повече аниони. Методи за определяне на степента на окисление на всеки от компонентите в комплекс сол е същото както в кислород-съдържащи киселини. Като се има предвид, че степента на окисление на елемента - цифров индикатор, че е важно да се посочи степента на окисление на метала.
Ако образуване на сол на метала е в основната подгрупата, неговото окисление е стабилна, съответстваща на броя на група е положителен. Ако солта съдържа метал такива подгрупи PS показващи различни валентността, валентността на метала може да се определи на киселинен остатък. Когато степента на окисляване на метала да се инсталира, поставени степента на окисление на кислород (-2), последвано от изчисляване на степента на окисление на централното тяло с помощта на химично уравнение.
Като пример, помисли за определянето на окисление за елементите на натриев нитрат (нормална сол). NaNO3. Сол основната подгрупа на група 1 метал се образува следователно степента на окисление на натрий е едно. В кислород в нитрат окисление на -2. За определяне на цифровата стойност на окислението се равнява + 1 + X-6 = 0. Решаването на това уравнение, ние получаваме че X трябва да бъде 5, това е степента на окисление на азот.

Ключови термини в IAD
Има специални условия, които са необходими, за да се научат студентите за процеса на окисление и редукция.
Степента на окисление е способността му да насочи прикрепя към себе си (за получаване на различни) електрони от някои от йони или атоми.
Окислителят се счита неутрални атоми или йони по време на химическата реакция се присъединява електрони.
Редуциращият агент ще незаредени атоми или йони, че в процеса на химическо взаимодействие губят своите собствени електрони.
Процедурата на окисляване е представена като електронен удар.
Възстановяване е свързано с приемането на допълнителни електрони незареден атом или йон.
Redox процес се характеризира с реакцията, в хода на която задължително се променя степента на окисление на атом. Това определение ни дава възможност да се разбере как е възможно да се определи дали реакцията на ISI.

правила ЗАМ разбор
Използването на този алгоритъм, коефициентите могат да бъдат разположени във всяка химична реакция.
Първо трябва да се поставят във всяка химическа състояние окисление. Отбележете, че в прост вещество окисляване състоянието на нула, тъй като няма изход (свързване) на отрицателните частици. Условия за поставяне на окисление в двукомпонентни и три елемент съединения бяха изследвани от нас по-горе.
След това е необходимо да се идентифицират онези атоми или йони, които са настъпили по време на преобразуването, окисление промени.
Записите от лявата страна на уравнението се изолира атоми или йони, които са се променили тяхната степен на окисление. Той е необходим за баланса. С течение на елементите, необходими за да покаже тяхната стойност.
Освен писмено тези атоми или йони, които се образуват по време на реакцията, знак + показва броя на електрони приема атом, - брой на отлети отрицателни частици. Ако процесът на взаимодействие са намалени окисление. Това означава, че електрони са взети атом (йон). Когато степента на окисление атом (йон) да дари електрони време на реакцията.
Най-малкият общ брой предприети за разделяне на първата, а след това да се хвърли по време на електрони, получени коефициенти. Point номера са необходими стереохимичните фактори.
Определя окислител, редуктор, процеси, които се случват по време на реакцията.
Последната стъпка ще бъде изравняването на стереохимични фактори в тази реакция.
например ЗАМ
Нека разгледаме по-практическо приложение на алгоритъма в определена химическа реакция.
Ние изчисляваме всички прости и сложни вещества.
Тъй като Fe и Cu са прости вещества, тяхното окисление е 0. В CuSO4, на Cu + 2, след това 2 кислород, сяра и 6. В FeSO4: Fe 2, следователно, за О 2, изчислено S 6.
Сега търсим елементите, които могат да се променят цифрите, в нашата ситуация, те ще бъдат с Fe и Cu.
Тъй като стойността след реакцията на железния атом е 2, 2 електрон е дадено в реакцията. Медни им индекси променени на 0 до 2, следователно медта се 2 електрони. Сега ние определяме броя на електроните са получили, и чугун атом и меден катион. По време на преобразуване взети катион два електрона меден същото електрон даден железен атом.
В този процес не е от значение за определяне на минималното общо кратно, като приема и прилага по време на преобразуване равен брой електрони. Стереохимичните фактори също ще съответстват на един. В реакцията на редуциращия агент ще проявяват свойствата на желязо, докато се окислява. Катион двувалентна мед се редуцира до чиста мед в реакцията, тя има най-висока степен на окисление.

процес на кандидатстване
Формула степен на окисление трябва да се знае за всеки ученик 8-9 клас, тъй като този въпрос е включен в работата OGE. Всички процеси, които се случват с окисляващ, намаляване на симптомите, играе важна роля в живота ни. Те са необходими метаболитни процеси в човешкото тяло.