Водороден пероксид - на
Водороден пероксид (водороден пероксид), Н 2О 2 - простият представителни пероксиди. Безцветна течност с "метален" вкус. безкрайно разтворим във вода. алкохол и етер. Концентрираните водни разтвори на експлозив. Водороден пероксид е добър разтворител. Водата се освобождава под формата на нестабилна кристална H2 O2 • 2H2 О.
Молекула на водороден пероксид има следната структура:
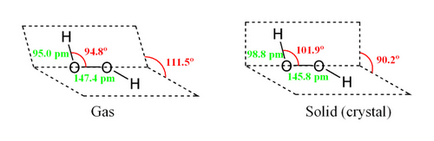
Поради асиметрията на молекула Н 2О 2 силно полярен (μ = 0,7 · 10 -29 m · CL). Относително високият вискозитет на течната водороден прекис причинена от разработена система на водородни връзки. Тъй кислородни атоми имат несподелени електронни двойки, Н 2О 2 молекула също може да образува донор-акцепторни връзки.
химични свойства
И двата кислородни атома са в междинно окисление на -1, което причинява способността да действа като пероксиди като окислители и редуктори. Най-характерната от тях окислителни свойства:
Чрез реакция с силни окислители водороден прекис действа като редуктор, се окислява с кислород:
Водороден пероксид молекула силно полярен, което поражда водородни връзки между молекули. Съобщение О-О е нестабилна, така че Н 2О 2 - нестабилно съединение лесно се разгражда. Също така може да допринесе за присъствието на преходни метални йони. В разредени разтвори на водороден прекис също не е стабилен и спонтанно диспропорциониране на О2 и Н2 О Реакцията се катализира диспропорциониране на преход метални йони, някои протеини:
Въпреки това, много чист водороден пероксид стабилна.
Водороден пероксид показва слаби киселинни свойства (К = 1,4 · 10 -12), и следователно се дисоциира в два етапа:
Действието на концентрирания разтвор Н 2О 2 в продължение на няколко хидроксиди в много случаи могат да бъдат разграничени метални пероксиди, които могат да се разглеждат като водороден пероксид сол (LI2 O2 MgO2 и др ...):
Водороден пероксид може да бъде както окислител и намаляване свойства. Например, чрез взаимодействие със сребърен оксид редуциращ агент е:
В реакция с калиев нитрит окислител съединение е:
Пероксид група [-О-О-] е част от много вещества. Такива вещества са посочени като пероксиди и пероксикиселини съединения. Те включват метални пероксиди (Na2 O2. BaO2 и др.). Киселини, съдържащи пероксид група, наречена пероксокиселини, например, peroksomonofosfornaya H3 PO5 и peroksidisernaya Н2 S2 О8 киселина.
Редоксисистемите имоти
Водороден пероксид окислител има. и намаляване на имоти. Той се окислява нитрит до нитрат. пресата йод от йодиди на метали, разделя ненаситени съединения в мястото на двойните връзки. Водороден пероксид възстановява златни и сребърни соли. и кислород в реакционната смес с воден разтвор на калиев перманганат в кисела среда.
Когато възстановяването на Н 2О 2, образуван Н2 О или ОН, например:
Под действието на силни окислители Н 2О 2 показва редуциращи свойства, освобождавайки свободен кислород:
KMnO4 реакция с Н 2О 2 се използва химичен анализ за определяне на Н 2О 2:
Окисляване на органични съединения с водороден пероксид (например, сулфиди и тиоли) се провежда за предпочитане в среда на оцетна киселина.
биологични свойства
водороден прекис се отнася до реактивни форми на кислород и при повишено образуване в клетката води до оксидативен стрес. Някои ензими. например глюкоза оксидаза. образувана по време на реакцията на редокси на водороден пероксид, който може да играе защитна роля като бактерицидно средство. В клетки на бозайници, няма ензими. което би намалило кислород водороден пероксид. Въпреки това, няколко ензимни системи (ксантин оксидаза. NAD (P) H-оксидаза, циклооксигеназа и т.н.) произвеждат супероксид. които спонтанно или чрез действието на супероксид дисмутаза се превръща в водороден прекис.
водороден прекис се получава в промишлеността за реакции, включващи органични съединения, по-специално, каталитично окисление на изопропилов алкохол:
Ценна продукт от тази реакция е ацетон.
В индустриален мащаб, водороден прекис се получава чрез електролиза на сярна киселина, която се образува по време на persulfuric киселина и след разлагане на последния да прекис и сярна киселина.
При лабораторни условия, при използване на реакция за получаване на водороден прекис:
Концентрация и пречистване на водороден пероксид се извършва внимателно дестилация.
приложение

3% разтвор на водороден пероксид
Поради силните си окислителни свойства на водороден пероксид са намерили широко приложение в дома и в промишлеността, където се използва, като белина в текстилната производството и при производството на хартия. Тя се използва като гориво - като окислител или като единичен компонент (разлагане на катализатора). Той се използва в аналитичната химия. като газообразуващ агент в производството на порести материали, в производството на дезинфектанти и избелващи агенти. В промишлеността, водороден прекис и установи неговото използване като катализатор на хидрогениране агент като епоксидира средство в епоксидиране на олефини.
Докато разредени разтвори използва за малки повърхностни рани водороден пероксид, проучвания са показали, че този метод на осигуряване на почистване и антисептично действие и удължава процеса на оздравяване. [1] [2] С добри почистващи свойства, водороден пероксид не е действително ускорява зарастването на рани. Относително високи концентрации, осигуряващи антисептично действие могат също да удължат времето за заздравяване поради повреди съседни клетки към раната. [3] Освен това, водороден прекис може да попречи на рани и насърчаване на белези в резултат на фрактура стартиращи кожата клетки. [4] Въпреки това, като средство за пречистване на комплекс профил дълбоки рани, септичен ивици, флегмон. и други гнойни рани, които затрудняват рехабилитация, Perique водород остава избор на лекарството. Тъй като има не само антисептично действие, но произвежда големи количества пяна, чрез взаимодействие с ензима пероксидаза. Което от своя страна позволява да омекоти и разделяне на тъкани от некротични зони, кръвни съсиреци, гной, които лесно се отмиват от последващо въвеждане в кухината на антисептичен разтвор рана. Без предварително третиране с водороден прекис, антисептичен разтвор не можете да изтривате данни патологични образувания, което води до значително увеличаване на времето за заздравяване на рани и да влоши състоянието на пациента.
Водороден пероксид се използва също за коса избелване [5] и избелване на зъбите [6]. но и в двата случая ефект се основава на окисление и следователно унищожаване на тъканта и следователно като употребата (особено за зъби) не се препоръчва от експерти.
В водороден прекис разтвори хранителната промишленост използва за дезинфекция на повърхности процес оборудване в пряк контакт с продуктите. В допълнение, предприятията за производство на млечни продукти, сокове, разтвори на водороден прекис се използва за дезинфекция на пакета (технология "Tetra Pak"). За технически приложения на водороден прекис, използвани в производството на електронно оборудване.
Домът се използва също и за премахване на петна MnO2. получени чрез взаимодействие перманганат "манган" калиеви обекти (благодарение на окислителни свойства).
Водороден прекис в аквариум
Този раздел липсва цитати източници на информация.
3% разтвор на водороден прекис се използва за съживяване аквариумни рибки задавяне и за почистване на резервоари и контрол на нежелани флора и фауна в аквариум (Hydra, planarians. Паразити, водорасли, бактерии и т.н.).
издаване
Предлага се под формата на водни разтвори, а стандартната концентрация от 1-6%, 30, 38, 50, 60, 85, 90 и 98%. 30% воден разтвор на водороден прекис, стабилизиран чрез добавяне на натриев фосфат се нарича perhydrol.
използването на опасни
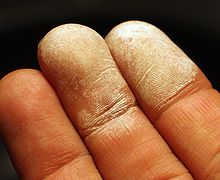
Кожата след излагане на това 30% разтвор на водороден пероксид.
Въпреки факта, че водороден пероксид не е токсичен. неговите концентрирани разтвори в контакт с кожата, лигавиците и дихателните пътища предизвика изгаряния. При високи концентрации недостатъчно чист водороден прекис може да бъде експлозив. Вреден поглъщане концентрирани разтвори. Причини изразени разрушителни промени, подобни на действието на основа. Леталната доза от 30% разтвор на водороден пероксид (perhydrol) - 50-100 мл. [7]
литература
Вижте какво "водороден пероксид" в други речници:
Водороден прекис - Водороден пероксид Системно Общо наименование Химична формула водороден пероксид ... Wikipedia
Кислородна вода - водороден пероксид Общи Системно име на водороден прекис Химична формула ... Wikipedia
Водороден прекис - (водороден пероксид), Н2О2, течност, т.к. 150,2shC. 30% водородни минути perhydrol разтвор. Концентриран воден разтвор на водороден прекис разтвори са експлозивни. Водороден пероксид е използван като окислител в пропеланта при получаването на различни ... ... Modern Енциклопедия
Водороден пероксид - (водороден пероксид), Н2О2, течност, точка на кипене 150,2 ° С 30% водородни минути perhydrol разтвор. Концентриран воден разтвор на водороден прекис разтвори са експлозивни. Водороден пероксид е използван като окислител в пропеланта при получаването на различни ... ... Illustrated Енциклопедичен речник
Пероксид - (преди пероксид) вещество, съдържащо пероксо O O (например, Н2О2 водороден пероксид, натриев пероксид, Na2O2). Пероксид освобождава кислород лесно. се препоръчва да се използва терминът за неорганични пероксиди съединения, ... ... Wikipedia
Цезий прекис - Обща Системно име пероксид цезий Традиционните имена цезий пероксид Химична формула емпиричната формула Cs2O2 Cs2O2 ... Wikipedia
Пероксид хром (VI) - пероксид, хром (VI) СгОз (О2) 2 или CrO5, синьо вещество не се изолира в чиста форма. Известно е, в разтвор или под формата на солвати с органични разтворители. Системно име ... Wikipedia
Кислородна вода живак - Обща Системно име на пероксид на живак и традиционни наименования пероксид живак HgO2 Химична формула Физични свойства Моларна маса ... Wikipedia
цинков пероксид - Систематично име Общата цинков пероксид традиционното име цинков пероксид Химична формула ZnO2 Физични свойства Статус (... Wikipedia